Le aldeidi sono composti organici in cui un carbonile (>C=O) è legato a un atomo di idrogeno e a un gruppo R, un residuo organico alifatico o aromatico, ma che può essere anche H nel caso più semplice (formaldeide), e sono quindi composti caratterizzati dalla presenza nella molecola del gruppo funzionale −CH=O, il gruppo formile. La loro formula generale è quindi R−CHO.
Il carbonile è un gruppo molto polare (>Cδ =Oδ−) e in esso gli atomi C e O hanno ibridazione sp2: questo fa sì che il carbonio carbonilico di un'aldeide sia al centro di un triangolo grossomodo equilatero sul cui piano giacciono l'ossigeno, l'idrogeno e l'atomo C del gruppo R direttamente legato al gruppo carbonile.
Le aldeidi si differenziano dai chetoni, che pure contengono il carbonile, perché in esse a quest'ultimo sono uniti due gruppi R (entrambi diversi da H). Questo per le aldeidi si traduce in una facile ossidabilità ad acidi carbossilici, che non si riscontra per i chetoni (che si ossidano solo in condizioni drastiche e con la necessaria rottura di un legame C−C):
RCH=O [O] → R−COOH
Inoltre, il carbonile aldeidico è generalmente più elettrofilo di quello di chetoni aventi struttura comparabile e gli eventuali idrogeni in alfa sono più facilmente enolizzabili.
Nella formaldeide, che è la prima rappresentante e quindi l'aldeide più semplice il carbonile è legato a due atomi di idrogeno (H2C=O). Questo fa sì che essa si differenzi dalle altre aldeidi per alcune proprietà: a) la mancanza di un idrogeno in alfa al carbonile preclude ogni canale di reazione legato all'enolizzazione; b) la facile ossidabilità arriva in questo caso fino a CO2; c) il carattere maggiormente elettrofilo del suo carbonile.
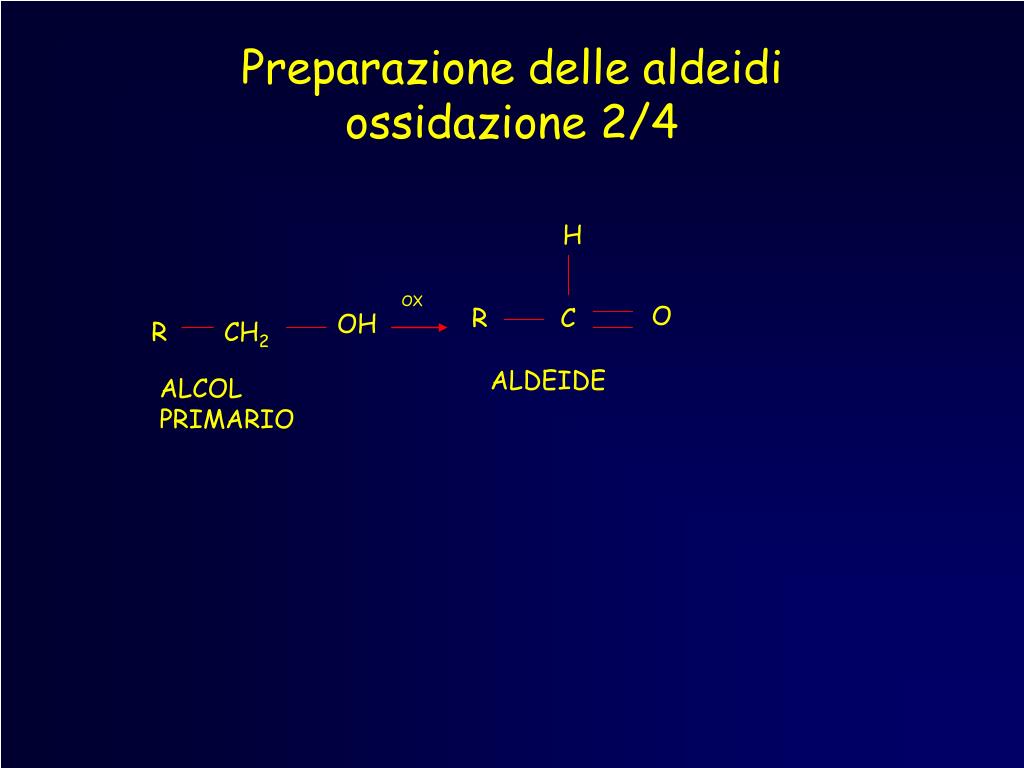
Il nome aldeide deriva da "alcol deidrogenato", che è una delle possibili modalità di preparazione, schematicamente:
RCH2−OH (-H2) → RCH=O
In natura vengono prodotte nei processi di fermentazione degli zuccheri.
Nomenclatura IUPAC
La nomenclatura IUPAC delle aldeidi segue regole simili a quella degli alcani, ma con le seguenti differenze:
- l'atomo di carbonio del gruppo -CHO si considera il primo atomo della catena principale.
- il nome che viene dato alla catena principale è simile quanto previsto per l'idrocarburo corrispondente con la perdita dell'ultima vocale e l'aggiunta del suffisso -ale. Il nome IUPAC delle aldeidi, in italiano, è maschile.
Quando il gruppo -CHO viene considerato un gruppo sostituente, prende il nome di "formil-".
Esempi di aldeidi
Come si vede dagli esempi seguenti, è comune la pratica di denominare le aldeidi con il nome dell'acido carbossilico corrispondente (ad esempio la "formaldeide" prende il nome dall'acido formico, dalla cui formula di struttura si differenzia per un solo atomo di ossigeno):
Sintesi
Sintesi in laboratorio
I metodi di laboratorio tramite i quali è possibile sintetizzare facilmente le aldeidi sono i seguenti:
- Ossidazioni di alcoli primari
Gli alcoli primari in generale possono essere facilmente ossidati da parte di un'ampia varietà di agenti ossidanti. Per la sintesi delle aldeidi è tuttavia necessario l'impiego di reagenti ad azione più blanda rispetto a più comuni sistemi ossidanti, quali KMnO4 o K2Cr2O7; infatti, in presenza di questi o loro simili, si otterrebbero direttamente gli acidi carbossilici corrispondenti. Per realizzare selettivamente l'ossidazione di una funzionalità alcolica primaria ad aldeide è possibile ricorrere alle seguenti trasformazioni:
- Ossidazione di Sarett-Collins : si impiega l'omonimo reagente, che consiste in un addotto tra anidride cromica e piridina (Py). Può essere facilmente sintetizzato in laboratorio tramite la reazione:
CrO3 2Py → CrO3·2Py
L'ossidazione dell'alcol avviene in buone rese e può essere schematizzata come segue:
R-CH2OH CrO3·2Py → R-CHO
- Ossidazione di Corey: si utilizza il piridinio clorocromato (PCC), un complesso che si ottiene miscelando anidride cromica, piridina e acido cloridrico. La reazione, condotta generalmente in solvente organico (per esempio CH2Cl2), è la seguente:
R-CH2OH PCC → R-CHO
- Ossidazione di Swern: La reazione degli alcoli primari con cloruro di ossalile (COCl)2 e dimetilsolfossido (DMSO) porta in buone rese all'ottenimento dell'aldeide corrispondente.
R-CH2OH DMSO (COCl)2 → RCHO (CH3)2S CO2 CO HCl
- Riduzione di cloruri acilici
I cloruri degli acidi carbossilici possono essere ridotti ad aldeidi tramite tri-t-butossi-alluminioidruro di litio, un donatore di idruro meno reattivo di LiAlH4. La reazione deve essere condotta alla temperatura di circa -78 °C.
R-COCl LiAlH[OC(CH3)3]3 → R-CHO
- Idratazione degli alchini terminali
Per effettuare questa reazione si adotta l'idroborazione degli alchini mediante borani stericamente impediti come il disiamilborano (abbreviato in Sia2BH), seguita dall'ossidazione dell'intermedio con perossido di idrogeno in ambiente basico:
HC≡CH Sia2BH → R-COH
Produzione industriale
Le aldeidi vengono prodotte su scala industriale a partire dai seguenti processi:
- idroformilazione di olefine (o oxosintesi)
- deidrogenazione di alcoli primari
- ossidazione di olefine.
Il processo di produzione industriale più utilizzato è quello di oxosintesi. Nel 1994 gli impianti di produzione delle aldeidi che impiegavano il processo di oxosintesi avevano una capacità complessiva (a livello mondiale) maggiore di 7 milioni di tonnellate all'anno.
Reazioni tipiche
Il gruppo funzionale delle aldeidi dona a questa categoria di composti la possibilità di subire alcune reazioni tipiche. Le aldeidi possono essere riconosciute tramite la reazione con la 2,4-dinitrofenilidrazina, che reagisce con il loro gruppo funzionale formando un precipitato di colore giallo-arancione, il quale può essere successivamente analizzato, determinandone il punto di fusione, per poter concludere quale aldeide è stata analizzata.
Ossidazione
Le aldeidi possono essere facilmente ossidate nell'acido carbossilico corrispondente tramite l'utilizzo di numerosi reagenti, come il permanganato di potassio o il dicromato di potassio. Essendo le aldeidi simili ai chetoni, ma con l'importante differenza che questi ultimi non possono essere facilmente ossidati, la reazione di ossidazione è molto utile per distinguere queste due categorie di composti organici. Per eseguire questa distinzione si usa in genere il reattivo di Tollens o quello di Fehling. Il risultato positivo di questi test conferma la presenza di aldeidi piuttosto che chetoni.
Riduzione
Tramite l'uso di agenti riducenti quali il litio alluminio idruro (LiAlH4) le aldeidi sono facilmente ridotte ai corrispondenti alcoli primari. In alternativa è possibile utilizzare boroidruro di sodio (NaBH4) che è un agente riducente più blando e non riduce i composti meno reattivi come esteri, ammidi ed acidi carbossilici. È quindi utile per ridurre selettivamente il carbonio carbonilico in una molecola che presenti, ad esempio, un gruppo aldeidico ed uno carbossilico.
Note
Bibliografia
- T. W. Graham Solomons, Chimica organica, 2ª ed., Bologna, Zanichelli, 2001, p. 57, ISBN 88-08-09414-6.
- (EN) AAVV, Ullmann's Encyclopedia of Industrial Chemistry, "Aldehydes, Aliphatic and Araliphatic", Wiley-VCH, 2002, DOI:10.1002/14356007.a01_321.
- Robert V. Hoffman, Organic chemistry: an intermediate text, 2ª ed., John Wiley and Sons, 2004, ISBN 0-471-45024-3.
Voci correlate
- Acetali
- Tioacetali
- Chetoni
- Condensazione aldolica
- Reazione di Cannizzaro
- Idroformilazione
- Reazioni di aldeidi e chetoni
- Sistematica organica
- Tautomeria cheto-enolica
Altri progetti
- Wikizionario contiene il lemma di dizionario «aldeidi»
- Wikimedia Commons contiene immagini o altri file su aldeidi
Collegamenti esterni
- (EN) Jerry March e William H. Brown, aldehyde, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Esperienze in laboratorio - Le aldeidi e i chetoni, su itchiavari.org.
- Reazioni e saggi di riconoscimento di aldeidi e chetoni , su itiskennedy.it.